-
產品詳情
-
聯係我們
注射用純化水設備
注射用水與(yu) 一般的超純水不同,它需要控製水中的熱源與(yu) 微生物,注射用水是一種無菌製劑,在很多藥廠中都應用的非常廣泛,並且在藥典與(yu) GMP中都有明確的規定,GMP中嚴(yan) 格規定“純化水、注射用水的製備、儲(chu) 存和分配應能防止微生物的滋生和汙染。儲(chu) 罐和輸送管道所用材料應無毒、耐腐蝕。藥典中規定,除一般的蒸餾水的檢查項目,如酸堿度、氯化物、硫酸鹽、鈣鹽、銨鹽、二氧化碳、易氧化物、不揮發物及重金屬均應符合規定外,尚須通過熱原檢查。

注射用水是通過將純化水進行蒸餾所製備出來的,並且裏麵的細菌內(nei) 毒素等指標都必須符合國內(nei) 的藥典規範,是生物製藥企業(ye) 中各類直接注射入人體(ti) 內(nei) 藥物的溶劑。注射用水係統都需要隔離外部汙染,同時也需要避免內(nei) 部對係統內(nei) 介質產(chan) 生二次汙染,並且注射用水係統還需能防止細菌等微生物的滋生。
適用領域:製藥用水、血液淨化、醫療器械、獸(shou) 藥、針劑、粉針劑、體(ti) 外診斷試劑、大輸液、生化製品用水、醫用無菌水、口服液用水
行業標準:
1.符合2010版中國藥典
2.符合美國、歐洲藥典要求
3.符合GMP標準、FDA認證要求
4.符合FDA認證要求
係統特點:
1.管道采用熱溶式氬弧焊焊接,或者采用衛生夾頭分段連接;
2.與(yu) 終端純水接觸的管線均滿足GMP3D要求,膠墊為(wei) PTPE,隔膜閥水平安裝時為(wei) 45度,循環管線安裝為(wei) 0.5的坡度,設最低點為(wei) 排放點;
3.管路采用清潔蒸汽消毒,消毒溫度121℃;
4.采用316L不鏽鋼管材內(nei) 壁電拋光作鈍化處理;
5.管道采取循環布置,回水流入貯罐,按照具體(ti) 施工要求可采用並聯或串聯的連接方法,
6.使用點閥門處的“盲管”段長度,對於(yu) 加熱係統采用小於(yu) 6倍管徑,冷卻係統采用小於(yu) 4倍管徑;
7.閥門采用不鏽鋼聚四乙烯隔膜閥,與(yu) 衛生夾頭連接;
8.采用PLC+觸摸屏自動控製方式,穩定可靠、精致美觀,自動模式為(wei) 一鍵式啟動,操作簡單方便;
9.人性化三維設計,符合人機工程學;
10.觸摸屏、開關(guan) 、儀(yi) 器、儀(yi) 表設立高度位置,符合國人平均身高方便人工操作;
11.當遇到濾材更換周期到、滿水、缺水、低壓、超壓在觸摸屏事件記錄欄會(hui) 記錄,當遇到水質、壓力、流量出現異常會(hui) 發出報警;
12.為(wei) 了實現各區段無死角,若純化水罐滿水後2兩(liang) 小時無波動,會(hui) 觸發整個(ge) 係統循環,防止管道長時間不流動滋生微生物;
13.製水係統與(yu) 供水係統分開控製,如遇更換耗材,可不必停止供水或者製水;
14.RO產(chan) 水、衝(chong) 洗時間可設定,當用水高峰期,可調節產(chan) 水時間,使用水點穩定用水;
15.采用進口海德能超低壓反滲透,脫鹽率高,使用壽命長,運行穩定,能耗下降20%;
16.主題材料全部采用行業(ye) 內(nei) 國際知名品牌,保質保量,並按具體(ti) 要求配置設計。
工藝流程:
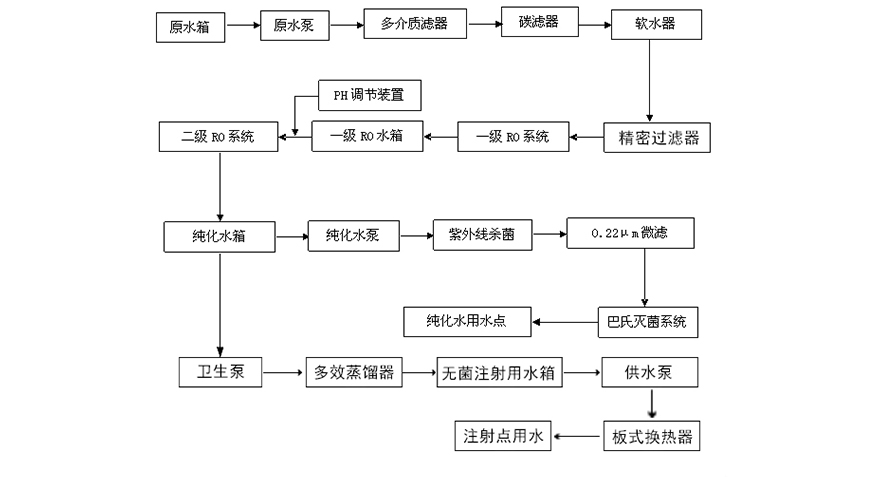
主要部件功能介紹:
1.原水箱,功用:貯存係統原水,對進水起調節作用,也對進水中的雜質起一定的沉澱作用。
2.砂濾器,功用:初步去除水中泥沙、雜質、懸浮物以及其它微粒等降低水的濁度。
3.碳濾器,功用:利用碳的吸附原理吸附水中異色、異味、餘(yu) 氯等。
4.軟水器,功用:利用陽樹脂置換水中的鈣鎂離子,降低水的硬度。
5.保安過濾器,功用:防止大顆粒雜質進入反滲透膜,造成對膜的損壞,保護反滲透膜。
6.雙級反滲透主機,功用:主要是通過反滲透過濾,達到生產(chan) 純化水之目的。
7.PH調節係統,功用:通過PH調節,去除水中的CO2 ,保證產(chan) 水水質。
8.純化水箱,功用:儲(chu) 存二級反滲透產(chan) 水,為(wei) 終端純化水用水點提供水源。
9.多效蒸餾機,功用:通過多效蒸餾方式製造注射用水。
10.紫外線殺菌器,功用:殺滅水中殘留細菌,保證出水水質。
11.巴氏殺菌係統,功用:用於(yu) 清洗純化水管路及純化水箱。
12.純化水增壓泵,功用:為(wei) 用水點輸送純水。
純化水、注射用水、無菌注射用水對比:
|
項目 |
純化水 |
注射用水 |
無菌注射用水 |
|
來源 |
蒸餾法、離子交換法、反滲透法或其他事宜的方法製得 |
純化水經過蒸餾所得 |
注射用水按照注射劑生產(chan) 工藝製備所得 |
|
性狀 |
無色的澄清液體(ti) 、無臭無味 |
無色的澄清液體(ti) 、無臭無味 |
無色的澄清液體(ti) 、無臭無味 |
|
酸堿度 |
PH值4.2—7.6 |
PH值5.0—7.0 |
PH值5.0—7.0 |
|
氯化物、硫酸鹽與(yu) 鈣鹽 |
不得出現渾濁 |
不得出現渾濁 |
不得出現渾濁 |
|
硝酸鹽 |
0.000 006% |
0.000 006% |
0.000 006% |
|
亞(ya) 硝酸鹽 |
0.000 002% |
0.000 002% |
0.000 002% |
|
氨 |
0.000 03% |
0.000 02% |
0.000 02% |
|
二氧化碳 |
不得出現渾濁 |
不得出現渾濁 |
|
|
易氧化物 |
粉紅色不得完全消失 |
粉紅色不得完全消失 |
粉紅色不得完全消失 |
|
不揮發物 |
遺留殘渣不得超過1mg |
遺留殘渣不得超過1mg |
遺留殘渣不得超過1mg |
|
重金屬 |
0.000 03% |
0.000 03% |
0.000 03% |
|
微生物限度 |
細菌、黴菌和酵母菌的總數每1ml不得超過100個(ge) |
細菌、黴菌和酵母菌的總數每1ml不得超過10個(ge) |
不在檢查微生物限度 |
|
細菌內(nei) 毒素 |
不要求 |
每1ml中含內(nei) 黴素量應小於(yu) 0.25EU |
每1ml中含內(nei) 黴素量應小於(yu) 0.25EU |
|
符合注射劑項下有關(guan) 規定 |
不要求 |
不要求 |
要求 |
|
類別 |
溶劑、稀釋劑 |
溶劑 |
溶劑、衝(chong) 洗劑 |
|
貯藏 |
密封保存 |
密封保存 |
密封保存 |
公司總部
Headquarters
 郵編: 610000
郵編: 610000  傳(chuan) 真:028-62583618
傳(chuan) 真:028-62583618
 電話:400-8732-808
電話:400-8732-808  電子郵件:lha.shenyuan@kailiqingjie.com
電子郵件:lha.shenyuan@kailiqingjie.com
 地址:成都市郫都區現代工業(ye) 港北片區港華路879號九川花園總部34棟2單元A區
地址:成都市郫都區現代工業(ye) 港北片區港華路879號九川花園總部34棟2單元A區





